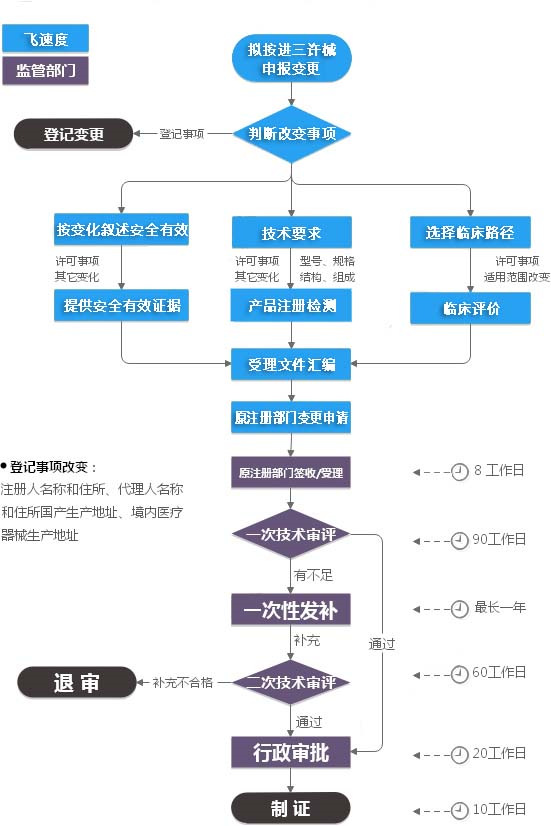
根据《食品药品监管总局关于印发境内第三类和进口
医疗器械注册审批操作规范的通知》的规定,登记事项变更包括受理和文件制作两个环节,受理和批件制作、登记事项变更由国家食品药品监督管理总局行政事项受理服务和投诉举报中心负责。行政事项受理服务中心将对进口第三类医疗器械的
注册人名称变更、
注册人住所变更、
代理人名称变更和
代理人住所变更等登记事项变更申报资料的完整性和规范性进行形式审查。如有以上四种情形,则需办理医疗器械注册登记事项变更。
备注:
* 根据《
医疗器械监督管理条例》《
医疗器械注册管理办法》《
体外诊断试剂注册管理办法》和《
医疗器械说明书和标签管理规定》等法规、规章,在我国申请医疗器械上市的,注册申请人、注册人和备案人的名称、住所、生产地址均应当使用中文。
进口医疗器械注册变更申请表
除了要求填写进口医疗器械注册变更申请表外,你还需要准备:
1、注册人关于变更情况的声明
2、原医疗器械注册证及其附件复印件
3、历次医疗器械注册变更文件复印件
4、根据具体变更情况选择提交以下文件:
(1)产品名称变化的对比表及说明。
(2)产品技术要求变化的对比表及说明。
(3)型号、规格变化的对比表及说明。
(4)结构及组成变化的对比表及说明。
(5)产品适用范围变化的对比表及说明,临床评价资料或其他支持资料。
(6)进口医疗器械生产地址变化的对比表及说明。
(7)注册证中“其他内容”变化的对比表及说明。
(8)其他变化的说明。
5、与产品变化相关的安全风险管理报告
6、变化部分对产品安全性、有效性影响的资料
7、针对产品技术要求变化部分的注册检验报告
8、境外注册人注册地或生产地址所在国家(地区)医疗器械主管部门出具的新的允许产品上市销售证明文件(如有)
9、境外注册人注册地或生产地址所在国家(地区)医疗器械主管部门出具的新的企业资格证明文件(如有)
10、境外申请人在中国境内指定代理人的委托书
11、代理人承诺书
12、代理人营业执照副本或者机构登记证明复印件
13、符合性声明和符合标准的清单
14、申请人所在地公证机构出具的公证件其中8、9项如无,需要提交说明。